기획
한국인 류마티스환자 생물학적제제 부작용 결과는?
메디칼타임즈=원종혁 기자 한국인 류마티스 환자에서 '생물학적제제 등록사업(KOBIO registry)'이 올해로 8년차를 맞았다.
사업 취지였던 이상반응 사례 업데이트 결과, 국내 환자들에서는 폐렴을 비롯한 대상포진, 결핵 등 발병 위험이 많게는 5배까지 증가하며 지속적인 약물 모니터링과 안전성 관리가 필요하다는 평가가 나왔다.
더불어 심혈관질환 위험이 높게 보고되는 류마티스관절염 환자에서는, TNF 알파 억제제 등의 생물학적제제 사용에도 고혈압 발병 위험과는 유의한 연관성을 보이지 않았다는 실마리 정보도 함께 공유됐다.
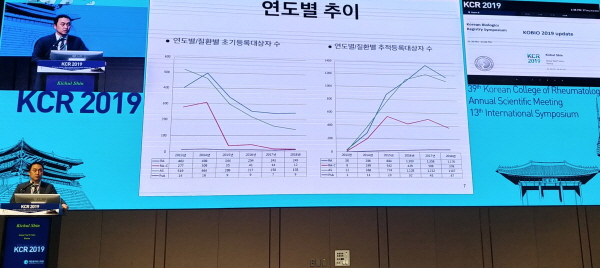
17일 대한류마티스학회 제39차 춘계학술대회에서 서울의대 류마티스내과 신기철 교수(보라매병원)가 KOBIO 레지스트리를 적극 활용한 국내 임상 분석 결과를 발표하고 있다.
17일 대한류마티스학회 제39차 춘계학술대회 및 제13차 국제심포지엄에서는 KOBIO 레지스트리를 적극 활용한 국내 임상 분석 결과가 공개됐다.
대한류마티스학회의 '생물학적제제 등록사업(KOBIO registry)'은 지난 2012년 대한류마티스학회 산하의 임상연구위원회가 주도한 전국 규모의 치료제 등록 프로그램이다.
사업 취지는 분명하다. 국내 류마티스 환자에서 생물학적제제를 사용하는 동안 발생한 약물의 이상반응을 확실히 조사하자는 것. 올해 춘계학술회에서 공개된 주요 연구 다수가 해당 레지스트리를 기반으로 했다는 점도 주목할 결과다.
현재 생물학적 항류마티스제제(bDMARDs)는 염증성 관절염을 치료하는 주요 치료 옵션으로 자리잡고 있다. 진료현장에서 류마티스관절염, 강직성척추염, 건선관절염 환자에까지 매일같이 처방되는 것.
문제는 이를 투약받는 환자의 기저질환과는 별개로 약물 이상반응이 빈번히 보고된다는 대목. 때문에 이상반응의 명확한 규명이 더없이 중요해지는 이유다.
고령 및 내과적 질환 동반 "생물학적제제 부작용 증가 각별한 주의"
KOBIO 사업의 업데이트를 발표한 서울의대 류마티스내과 신기철 교수(보라매병원)는 "일차 목표는 한국인 류마티스 질환에서 생물학적제제 및 표적치료제의 안전성 자료를 수집하는 것이지만, 나아가 류마티스관절염에 이어 강직성척추염 환자 등록증례를 많이 확보했다는 강점도 주목할 부분"으로 밝혔다.
현재 전국 44개 의료기관이 참여해 2019년 5월 9일 기준 류마티스관절염과 강직성척추염, 건선관절염에 각각 5292명, 5160명, 177명의 추적등록 증례를 쌓고 있다.
더욱이 올해 초기등록 환자로, 류마티스관절염에 2080명의 증례를 달성한 것으로 나타났다.
관전 포인트는, 국내 레지스트리 등록사업을 활용한 실제 처방상황에서 보고된 생물학적제제들에서의 이상반응 사례였다. 무작위대조군임상(RCT)을 포함한 기타 임상시험들에서는 장기간 부작용 모니터링이 현실적으로 어렵기 때문에, 국가 차원의 레지스트리 등록 연구가 중요해지는 것이다.
올해 업데이트 분석 결과를 보면 전국 26개 의료기관에서 생물학적제제 사용 중 발생할 수 있는 급성심근경색을 비롯한 폐색전증, 결핵, 악성종양 등 20가지에 이르는 모든 이상반응을 자세히 수집했다.
이에 따라 2018년 10월 기준 생물학적제제 증례 1915건, 합성 제제 693건이 검토완료 단계를 거쳤다. 여기엔 '엔브렐'을 비롯한 '레미케이드' '램시마' '휴미라' '심퍼니' '맙테라' '오렌시아' '악템라' '젤잔즈정' '브랜지스' '렌플렉시스' 등 사용 환자들이 등록됐다.
아주의대 김현아 교수.
이상반응 사례를 분석한 아주의대 김현아 교수는 "류마티스관절염에 생물학적제제가 도입되면서 환자의 질병 활성도 조절에 큰 기여를 했다는 점은 간과할 수 없다"면서도 "이번 분석 결과 실제 이상반응은 높게 나와 지속적인 관찰이 필요하다"는 평가를 내렸다.
그러면서 "약물 사용 중 감염이나 대상포진 등의 부작용이 기존 항류마티스제제를 사용하는 것보다 더 발생할 수 있고 질병의 중증도도 더 높았다"며 "특히 고령을 비롯한 내과적 질환이 동반된 환자에서는 약제의 부작용이 증가하므로 각별한 주의가 기울여야 할 것"으로 밝혔다.
이번 결과, 류마티스관절염 환자에서 생물학적제제를 사용한 경우 기존 항류마티스약제와 비교해 이상반응 및 중증 이상반응 비율이 2.4배 높게 나타났다.
더불어 생물학적제제 치료군에서는 폐렴을 비롯한 대상포진, 결핵 등 발병 위험이 1.8배에서 최대 5배까지 높았다는 대목.
김 교수는 "해외 데이터와 비교해서도 대상포진이나 결핵 등의 발생률이 약 1.5배, 2.7배 정도 높게 보고됐다"며 "치료기간 생물학적제제 사용 중단 원인 가운데 약 30%가 이상반응이 차지했다"고 보고했다.
따라서 추후에도 국내에서 시판되는 생물학적제제의 안전성과 제제의 변경, 중단에 대한 임상데이터의 지속적인 수집과 분석이 필요할 것으로 전했다.
좌장을 맡은 전남의대 이신석 교수는 "감염증과 관련 국내 자료가 만들어지면 실제 환자 치료에서 생물학적제제 사용을 시작할때 대상포진 백신 접종을 권고하고 치료 방향을 잡아간다든지 하는 가이드라인 작업에도 도움이 될 것 같다"고 덧붙였다.
고혈압 위험 높은 류마티스관절염 "생물학적제제 사용 연관성 없어"
이날 KOBIO 레지스트리를 활용한 생물학적제제(bDMARDs) 사용과 류마티스관절염 환자에서 고혈압 유병의 연관성을 파악해본 결과지도 참석자들의 눈길을 끌었다.
대구가톨릭의대 류마티스내과 김성규 교수는 "통상 류마티스관절염 환자에서 심혈관 위험은 48%, 사망 위험은 50% 정도가 높게 나타나는 것으로 보고된다"며 "심혈관질환자의 약 40% 정도에서 고혈압을 가진 것으로 나타나는데 RA 환자에서 고혈압은 특히 중요한 위험인자로 꼽힌다"고 강조했다.
그러면서 "2000년대 들어서면서부터 생물학적제제 사용이 많아졌는데 이러한 치료제들이 고혈압에 어떠한 영향을 미치는지 다양한 연구들이 진행되고 있다"며 "TNF 알파나 IL-6 가 류마티스관절염에서 주요 인자로 거론되는데, 이로인한 염증 사이토카인들이 혈압을 증가시키는 것과 연관성을 가진다는 사실들이 포착된 바 있다"고 설명했다.
실제 2015년 발표된 11개 RCT 임상을 메타분석한 결과에서도 TNF 억제제를 사용한 환자군에서는 고혈압 위험을 늘리는 유의한 결과를 보였다. 이때 연관성은 '써톨리주맙 페골'에서만 유의한 연관성을 보였고,에타너셉트 및 골리무맙, 인플릭시맙에는 차이가 없었다.
따라서 국내 레지스트리 자료를 활용한 실제 한국인 결과는 주목을 받았다.
2012년부터 2018년까지 등록된 996명의 류마티스관절염 환자를 따로 뽑아 연관성 분석을 시행했다. 대상 환자군은 TNF 알파 억제제로 '아바타셉트'와 '토실리주맙'을 사용한 이들이었다.
그 결과, TNF 억제제를 사용한 환자군에서 새롭게 고혈압을 진단받은 비율은 62명(6.2%)으로 나타났다. 치료기간 화학합성 항류마티스제제(csDMARDs)와 생물학적제제 사이에 고혈압 발병률에는 유의한 차이가 없었다.
다만 환자등록 초기에 수축기혈압이 높거나 류마티스인자 양성, 메토트렉세이트(MTX) 사용군에서는 고혈압으로 진행하는데 유의한 연관성을 보였다.
이외 에타너셉트가 기존 화학합성 항류마티스제제와 비교해 고혈압 위험을 증가시키지 않는 것으로 확인된 점도 시사점으로 꼽았다.
김성규 교수는 "이번 레지스트리 결과 생물학적제제에서 기존 화학합성 치료제와 비교해 고혈압 유병 위험을 증가시키지 않는 것"으로 전했다.
이어 "TNF 억제제들이 강력한 항염작용으로 인해 고혈압을 발생 위험을 줄일 것으로 기대했지만 앞서 미국 대규모 코호트 임상에서도 유의한 결과지를 보이지는 않았다"고 덧붙였다.
한편 KOBIO 레지스트리 사업을 기반으로 진행된 이번 국내 역학 연구들은, 작년 학술회에서 주제 공모 이후 선정됐다. 약물의 이상반응에 초점을 맞춰 시작된 연구가 관절염 분야 다양한 연관성 분석에까지 결실을 맺는 상황에서, 학계는 국내 근거구축을 다질 수 있는 발판으로 참여 확대를 부탁했다.